中國化妝品新原料注冊備案指南
背景介紹
2020年6月29日,中國國務(wù)院正式頒布《化妝品監(jiān)督管理條例》(Cosmetics Supervision and Administration Regulation, CSAR,國令第727號),并于2021年1月1日正式實施。CSAR的出臺標志著中國化妝品監(jiān)管體系邁入全新的發(fā)展階段,確立了以安全性、科學(xué)監(jiān)管和全生命周期管理 為核心的現(xiàn)代化管理體系。
在CSAR框架下,化妝品新原料管理制度經(jīng)歷了重大改革,國家藥品監(jiān)督管理局(NMPA)陸續(xù)發(fā)布了《化妝品注冊備案管理辦法》、《化妝品新原料注冊備案資料管理規(guī)定》等配套法規(guī),明確了新原料的分類、注冊備案要求及安全監(jiān)測制度。此外,CSAR引入了三年安全監(jiān)測期,要求企業(yè)在新原料上市后持續(xù)提交安全性數(shù)據(jù)和不良反應(yīng)報告,以確保產(chǎn)品的長期安全性。新法規(guī)的實施不僅明確了化妝品新原料的準入門檻,也推動了行業(yè)向更加科學(xué)化、透明化和國際化的方向發(fā)展。
本指南旨在幫助化妝品企業(yè)全面理解并嚴格遵循CSAR及其配套法規(guī)的要求,確保新原料在中國市場的合規(guī)性與安全性。通過系統(tǒng)性解讀新原料的注冊備案流程、資料要求及測試要求,本指南將為企業(yè)提供清晰的合規(guī)指引,降低合規(guī)風(fēng)險,提升市場競爭力,助力行業(yè)健康、可持續(xù)發(fā)展。
化妝品新原料定義及如何判斷化妝品新原料
為加強監(jiān)管并保障消費者安全,企業(yè)需明確化妝品新原料的定義、準確判斷所用原料是否屬于新原料,并依法履行注冊或備案義務(wù)。
化妝品新原料定義
“在我國境內(nèi)首次使用于化妝品的天然或者人工原料為化妝品新原料。”(《化妝品監(jiān)督管理條例》第二章第十一條)
如何判斷化妝品新原料?
只有原料預(yù)期的使用方法、使用部位、使用目的符合化妝品的相關(guān)屬性,才可以按照化妝品新原料申請注冊或者進行備案。如某種原料發(fā)揮作用的使用方法是通過口服或者注射,不符合CSAR對化妝品使用方法的描述,即“涂擦、噴灑或者其他類似方法”,或者該原料的使用部位、使用目的不屬于化妝品定義范疇的,則不能夠按照化妝品新原料申請注冊或進行備案。
國內(nèi)外首次使用的新原料:首次發(fā)現(xiàn)并確認適用于化妝品的原料,或者是已知原料但在國內(nèi)外尚未用于化妝品的原料。
境內(nèi)首次使用的新原料:已在境外應(yīng)用于化妝品,但在我國境內(nèi)尚未應(yīng)用于化妝品的原料。
改進創(chuàng)新的新原料:改進創(chuàng)新的新原料具體包括以下兩種情形:
(1)對使用目的、安全使用量明確的已使用化妝品原料,調(diào)整其使用目的為防腐劑、防曬劑、著色劑、染發(fā)劑、祛斑美白劑。
(2)對使用目的、安全使用量明確的已使用原料進行改進和創(chuàng)新,可通過優(yōu)化原料制備技術(shù)和生產(chǎn)工藝,且改變原料物質(zhì)基礎(chǔ)等方面開展實質(zhì)創(chuàng)新性研究,同時提升原料安全、功效、穩(wěn)定、質(zhì)量可控性。
已收錄于《已使用化妝品原料目錄》(以下簡稱《目錄》)的原料或者包含于《目錄》中已收載的類別原料中的具體原料,以及發(fā)揮功效的物質(zhì)基礎(chǔ)與《目錄》中的原料一致的,不屬于化妝品新原料。
為了更精準地判斷化妝品原料的監(jiān)管狀態(tài),企業(yè)可以借助全球化妝品法規(guī)數(shù)據(jù)庫。GlobalCosIng整合了包括中國、歐盟、美國、加拿大、東盟、韓國、日本等多個國家和地區(qū)的化妝品原料法規(guī)信息。企業(yè)可快速檢索某一原料在不同市場的合規(guī)狀態(tài),同時判斷其是否屬于中國市場的化妝品新原料,并獲得相應(yīng)的監(jiān)管要求。這不僅有助于企業(yè)在中國市場合規(guī)運營,也能幫助其制定全球市場的原料合規(guī)策略。
化妝品新原料分類
化妝品新原料分為兩大類:
風(fēng)險程度較高的化妝品新原料:防腐劑、著色劑、祛斑/美白劑、防曬劑和染發(fā)劑
非高風(fēng)險的化妝品新原料
化妝品新原料監(jiān)管部門
在中國,化妝品新原料的監(jiān)管主要由國家藥品監(jiān)督管理局(NMPA)負責(zé),統(tǒng)籌管理新原料的注冊、備案及安全監(jiān)測。同時,各級地方藥品監(jiān)督管理部門也承擔(dān)相應(yīng)的監(jiān)督檢查職責(zé),確保新原料的合規(guī)使用與市場安全。
國家藥品監(jiān)督管理局(NMPA):主要負責(zé)化妝品新原料的注冊和備案審查,組織制定和發(fā)布化妝品新原料管理法規(guī)、技術(shù)規(guī)范,監(jiān)督化妝品新原料的安全性評估等。
地方藥品監(jiān)督管理局:主要負責(zé)對轄區(qū)內(nèi)企業(yè)使用新原料的化妝品進行監(jiān)督檢查,配合國家藥監(jiān)局對新原料的安全監(jiān)測,收集不良反應(yīng)報告,監(jiān)督企業(yè)是否按照法規(guī)要求備案或注冊化妝品新原料等。
化妝品新原料在中國市場上市要求
在中國,化妝品新原料的上市需符合《化妝品監(jiān)督管理條例》(CSAR)及相關(guān)法規(guī)的要求,在進行化妝品原料的初步評估后,根據(jù)原料的風(fēng)險類別,完成注冊或備案及安全監(jiān)測,確保其安全性和合規(guī)性。
根據(jù)《化妝品監(jiān)督管理條例》,國家對風(fēng)險程度較高的化妝品新原料實行注冊管理,對其他化妝品新原料實行備案管理。具有防腐、防曬、著色、染發(fā)、祛斑美白功能的化妝品新原料,經(jīng)國務(wù)院藥品監(jiān)督管理部門注冊后方可使用;其他化妝品新原料應(yīng)當(dāng)在使用前向國務(wù)院藥品監(jiān)督管理部門備案。
以下為兩類化妝品新原料的注冊備案流程:
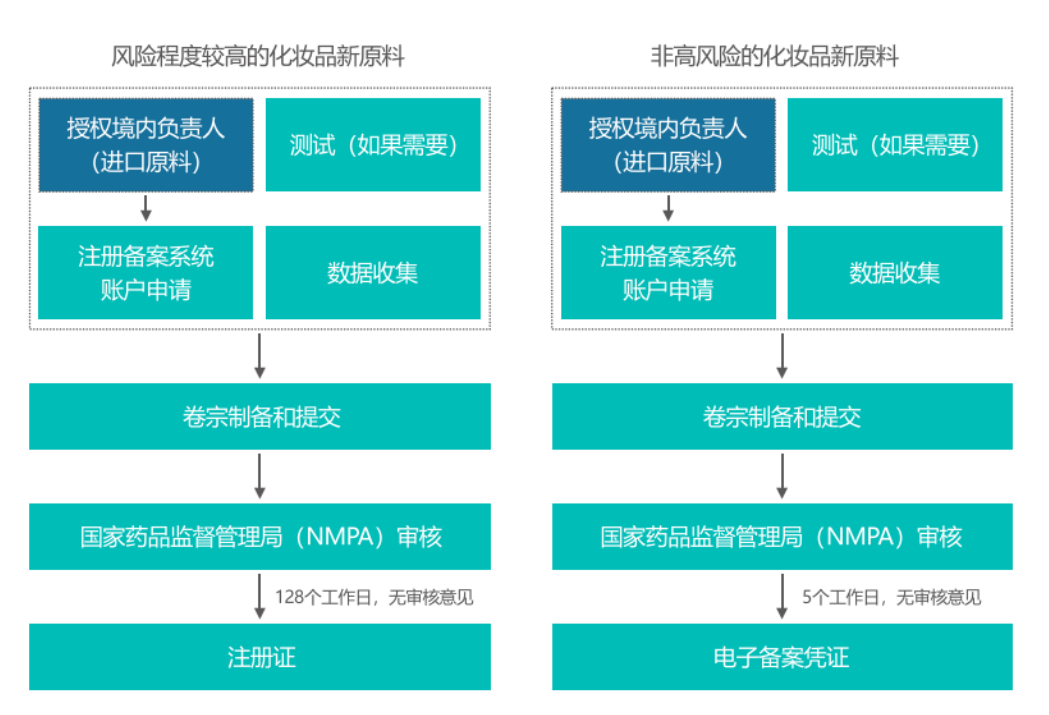
注:中國化妝品原料同時受中國化學(xué)品法規(guī)的監(jiān)管,如果出口的化妝品原料屬于中國新化學(xué)物質(zhì),還需要在生態(tài)環(huán)境部進行新化學(xué)物質(zhì)申報。
化妝品新原料境內(nèi)責(zé)任人職責(zé)與資質(zhì)要求
根據(jù)《化妝品監(jiān)督管理條例》(CSAR)及相關(guān)法規(guī)要求,在中國申請化妝品新原料注冊或備案的境外企業(yè),必須指定一家在中國境內(nèi)設(shè)立的企業(yè)法人作為境內(nèi)責(zé)任人,負責(zé)新原料的合規(guī)管理及安全監(jiān)測。
境內(nèi)責(zé)任人的職責(zé):
以注冊人、備案人的名義,辦理化妝品新原料注冊、備案;
協(xié)助注冊人、備案人開展化妝品新原料安全監(jiān)測與報告工作;
協(xié)助注冊人、備案人實施化妝品新原料召回工作;
按照與注冊人、備案人的協(xié)議,對投放境內(nèi)市場的化妝品新原料承擔(dān)相應(yīng)的質(zhì)量安全責(zé)任;
配合藥品監(jiān)督管理部門的監(jiān)督檢查工作。
化妝品新原料注冊備案資料要求
新原料注冊備案資料要求概覽
化妝品新原料注冊備案資料應(yīng)當(dāng)清楚闡述新原料的來源和研制情況、制備工藝及其質(zhì)量控制情況和安全評估情況等內(nèi)容,應(yīng)當(dāng)能夠充分證明在限定的使用條件下,將新原料用于化妝品生產(chǎn)的安全性和風(fēng)險可控性。根據(jù)《化妝品新原料注冊備案資料管理規(guī)定》,化妝品新原料注冊人、備案人申請化妝品新原料注冊或辦理新原料備案的,應(yīng)當(dāng)提交以下資料:
注冊人、備案人和境內(nèi)責(zé)任人的名稱、地址、聯(lián)系方式;
新原料研制報告;
新原料的制備工藝、穩(wěn)定性及其質(zhì)量控制標準等研究資料;
新原料安全評估資料。
化妝品新原料注冊人、備案人或境內(nèi)責(zé)任人應(yīng)當(dāng)根據(jù)所申報注冊或進行備案新原料的具體情形分類,按照化妝品新原料注冊和備案資料要求整理并提交相應(yīng)的注冊和備案資料。
同時,應(yīng)當(dāng)結(jié)合新原料注冊和備案資料相關(guān)技術(shù)信息,編制并提供用于注冊和備案信息公開的化妝品新原料技術(shù)要求資料,在新原料獲得批準或完成備案后,作為批準證書或備案憑證的附件對外公布,供社會公眾查詢參閱。
新原料研制報告
化妝品新原料研制報告一般應(yīng)當(dāng)包括以下內(nèi)容:
原料研發(fā)背景;
原料基本信息;
原料使用信息;
功能依據(jù)資料;
新原料研制相關(guān)的其他資料。
新原料制備工藝簡述
化妝品新原料制備工藝簡述應(yīng)當(dāng)結(jié)合原料來源特征,對原料生產(chǎn)的主要工藝步驟、工藝參數(shù)等進行簡要描述,并說明生產(chǎn)過程是否可能引入安全性風(fēng)險物質(zhì)及其控制措施。
新原料質(zhì)量控制標準
化妝品新原料質(zhì)量控制標準一般應(yīng)當(dāng)包括以下內(nèi)容:
穩(wěn)定性試驗數(shù)據(jù);
質(zhì)量規(guī)格指標及其檢驗方法;
可能存在的安全性風(fēng)險物質(zhì)及其控制標準等。
新原料安全性評價資料
化妝品新原料安全性評價資料一般應(yīng)當(dāng)包括毒理學(xué)安全性評價資料和安全風(fēng)險評估資料,并按照下列要求進行編制:
毒理學(xué)安全性評價資料,應(yīng)當(dāng)結(jié)合申報注冊和進行備案新原料的特征,判定新原料應(yīng)當(dāng)屬于的具體情形,按照相應(yīng)的毒理學(xué)試驗項目資料要求進行編制;
安全風(fēng)險評估資料,包括原料安全使用量評估資料和原料中可能存在的安全性風(fēng)險物質(zhì)及其控制措施等評估資料。應(yīng)當(dāng)按照國家藥品監(jiān)督管理局制定的化妝品安全評估原則和程序等相關(guān)要求,對新原料以及可能同時存在的安全性風(fēng)險物質(zhì)進行評估。
化妝品新原料注冊備案測試要求
根據(jù)《化妝品監(jiān)督管理條例》(CSAR)以及《化妝品新原料注冊備案資料管理規(guī)定》,化妝品新原料需進行相應(yīng)的安全評估和測試,以確保其安全性和合規(guī)性。新原料的安全性評估通常需要進行理化、微生物、功效評價、毒理、穩(wěn)定性等測試。
毒理學(xué)測試
申請注冊或進行備案的化妝品新原料,原則上應(yīng)當(dāng)提供以下毒理學(xué)試驗項目資料:
急性經(jīng)口或急性經(jīng)皮毒性試驗
皮膚和眼刺激性/腐蝕性試驗
皮膚變態(tài)反應(yīng)試驗
皮膚光毒性試驗(原料具有紫外線吸收特性需做該項試驗)
皮膚光變態(tài)反應(yīng)試驗(原料具有紫外吸收特性需做該項試驗)
致突變試驗(至少應(yīng)當(dāng)包括一項基因突變試驗和一項染色體畸變試驗)
亞慢性經(jīng)口或經(jīng)皮毒性試驗(如果該原料在化妝品中使用經(jīng)口攝入可能性大時,應(yīng)當(dāng)提供亞慢性經(jīng)口毒性試驗)
致畸試驗
慢性毒性/致癌性結(jié)合試驗
吸入毒性試驗(原料有可能吸入暴露時需做該項試驗)
長期人體試用安全試驗
根據(jù)原料的特性和用途,需提供其他項目的毒理學(xué)試驗資料
根據(jù)申報注冊或進行備案新原料的用途、理化特性、定量構(gòu)效關(guān)系、毒理學(xué)資料、臨床研究、人群流行病學(xué)調(diào)查以及類似化合物的毒理等情況,增加或減免相應(yīng)的毒理學(xué)試驗項目。
實驗室資質(zhì)
在中國,化妝品新原料的注冊和備案所涉及的測試必須由具備相應(yīng)資質(zhì)的實驗室進行。監(jiān)管部門(國家藥品監(jiān)督管理局NMPA)對實驗室的資質(zhì)有嚴格要求,以確保測試數(shù)據(jù)的科學(xué)性和可靠性。
出具毒理學(xué)試驗報告和防腐、防曬、祛斑美白、防脫發(fā)功效評價等項目檢驗報告的實驗室必須滿足以下要求之一:
取得化妝品領(lǐng)域的檢驗檢測機構(gòu)資質(zhì)認定(CMA)
中國合格評定國家認可委員會(CNAS)認可
符合國際通行的良好臨床操作規(guī)范(GCP)
良好實驗室操作規(guī)范(GLP)
理化和微生物檢驗報告及防腐、防曬、祛斑美白、防脫發(fā)之外的功能評價報告等:
由化妝品新原料注冊人、備案人自行或者委托具備相應(yīng)檢驗?zāi)芰Φ臋z驗檢測機構(gòu)出具即可。
檢驗方法要求
理化微生物和評價方法要求:
化妝品新原料理化和微生物檢驗、人體安全性和功效評價試驗項目,原則上應(yīng)參考《化妝品安全技術(shù)規(guī)范》或者《中華人民共和國藥典》等規(guī)定的檢驗方法。《化妝品安全技術(shù)規(guī)范》、《中華人民共和國藥典》未規(guī)定方法的項目,應(yīng)按照國家標準、國際通行方法或者使用自行開發(fā)的試驗方法進行檢驗。使用自行開發(fā)試驗方法的,應(yīng)同時提交該方法的適用性和可靠性相關(guān)資料。
毒理學(xué)方法要求:
新原料毒理學(xué)試驗項目應(yīng)按照《化妝品安全技術(shù)規(guī)范》規(guī)定的試驗方法開展。《化妝品安全技術(shù)規(guī)范》未規(guī)定方法的項目,應(yīng)按照國家標準或國際通行方法進行檢驗。
動物替代方法要求:
使用動物替代方法進行毒理學(xué)安全性評價的,應(yīng)根據(jù)原料的結(jié)構(gòu)特點、特定的毒理學(xué)終點選擇合適的整合測試和評估方法(IATA)評價新原料的毒性。應(yīng)用的動物替代試驗方法尚未收錄于中國《化妝品安全技術(shù)規(guī)范》的,該項替代試驗方法應(yīng)為國際權(quán)威替代方法驗證機構(gòu)已收錄的方法,且同時提交該方法能準確預(yù)測該毒理學(xué)終點的證明資料。證明資料應(yīng)包括該項替代試驗方法研究過程簡述和不少于10種已知毒性受試物的研究數(shù)據(jù)、結(jié)果分析、研究結(jié)論等內(nèi)容。
化妝品新原料注冊備案周期
化妝品新原料的注冊備案周期根據(jù)原料屬性、適用情形以及數(shù)據(jù)缺口而定。針對原料的數(shù)據(jù)缺口或者可行性分析可聯(lián)系我們進行專業(yè)咨詢。以下為新原料注冊備案的官方審評周期。
低風(fēng)險新原料(需備案)
化妝品新原料備案人按照國家藥品監(jiān)督管理局的要求提交資料后即完成備案。
高風(fēng)險新原料(需注冊)
形式審查:申請人提交注冊申請后,受理機構(gòu)應(yīng)在5個工作日內(nèi)完成形式審查。受理機構(gòu)將自受理注冊申請后3個工作日內(nèi),將申請資料轉(zhuǎn)交技術(shù)審評機構(gòu)。
技術(shù)審評:技術(shù)審評機構(gòu)將自收到申請資料之日起90個工作日內(nèi),按照技術(shù)審評的要求組織開展技術(shù)審評。(復(fù)核申請:技術(shù)審評結(jié)論為審評不通過,申請人有異議的,可以自收到技術(shù)審評結(jié)論之日起20個工作日內(nèi)申請復(fù)核。技術(shù)審評機構(gòu)自收到復(fù)核申請之日起30個工作日內(nèi)作出復(fù)核結(jié)論。)
國家藥品監(jiān)督管理局自收到技術(shù)審評結(jié)論之日起20個工作日內(nèi),對技術(shù)審評程序和結(jié)論的合法性、規(guī)范性以及完整性進行審查,并作出是否準予注冊的決定。
受理機構(gòu)自國家藥品監(jiān)督管理局作出行政審批決定之日起10個工作日內(nèi),向申請人發(fā)出化妝品新原料注冊證或者不予注冊決定書。
上市后監(jiān)管要求
根據(jù)《化妝品監(jiān)督管理辦法》規(guī)定,化妝品新原料的注冊人或備案人應(yīng)建立完善的上市后安全風(fēng)險監(jiān)測與評估體系,持續(xù)開展對新原料安全性的追蹤研究,并對其使用情況和安全狀況進行動態(tài)監(jiān)測與評估。
對于已經(jīng)取得注冊、完成備案的化妝品新原料實行安全監(jiān)測制度,安全監(jiān)測的期限為3年,自首次使用化妝品新原料的化妝品取得注冊或者完成備案之日起算。安全監(jiān)測的期限內(nèi),化妝品新原料注冊人、備案人可以使用該化妝品新原料生產(chǎn)化妝品。化妝品新原料注冊人、備案人應(yīng)當(dāng)在化妝品新原料安全監(jiān)測每滿一年前30個工作日內(nèi),匯總、分析化妝品新原料使用和安全情況,形成年度報告報送國家藥品監(jiān)督管理局。對存在安全問題的化妝品新原料,由國務(wù)院藥品監(jiān)督管理部門撤銷注冊或者取消備案。3年期滿未發(fā)生安全問題的化妝品新原料,納入國務(wù)院藥品監(jiān)督管理部門制定的已使用的化妝品原料目錄。
此外,使用化妝品新原料生產(chǎn)化妝品的注冊人或備案人,應(yīng)及時向新原料的注冊人或備案人反饋其使用與安全情況。當(dāng)發(fā)現(xiàn)可能與新原料相關(guān)的不良反應(yīng)或其他安全問題時,化妝品注冊人或備案人應(yīng)立即采取風(fēng)險控制措施,通知新原料注冊人或備案人,并按規(guī)定向所在地省、自治區(qū)、直轄市藥品監(jiān)督管理部門報告。
我們的服務(wù)
中國化妝品注冊備案
中國化妝品新原料注冊備案
中國化妝品原料安全信息報送碼申請
中國化妝品安全與功效檢測
毒理安全評估
配方/標簽/原料審核
境內(nèi)責(zé)任人
上述信息,涵蓋圖片、視頻以及各類文字資料,美天彩僅扮演信息存儲的角色。若存在任何侵犯知識產(chǎn)權(quán)或其他合法權(quán)益的情形,請立即聯(lián)系我們刪除,切實維護您的權(quán)益。
鄭重聲明
- 延伸閱讀:

Experts Q & A
外貿(mào)專家答疑
為了幫助您更快地解決問題,建議向我們的外貿(mào)專家進行咨詢,提供專業(yè)的方案咨詢和策劃。


馬上留言 (0) 0